Antoine Triller, directeur de l’« Institut de Biologie de l’Ecole Normale Supérieure » (Inserm U1024, CNRS/ENS Paris), et son équipe, en collaboration avec des chercheurs de l’université Northwestern (Chicago), viennent de mettre au jour un nouveau mécanisme responsable des troubles de la mémoire dans la phase initiale de la maladie d’Alzheimer. Leurs travaux paraissent le 10 juin dans la revue Neuron.
La maladie d’Alzheimer à un stade précoce se distingue par des troubles particuliers de la mémoire. Il a été démontré que cette défaillance implique des dysfonctionnements et des détériorations des synapses (zones de contact entre les neurones) dus aux oligomères béta-amyloïdes solubles (A?o). En se déposant sur la membrane des neurones, ces derniers s’accumulent et forment des plaques amyloïdes extracellulaires. Ces plaques altèrent alors de façon significative et très rapide la plasticité synaptique. Dans cette étude, Antoine Triller et son équipe ont étudié les mécanismes expliquant comment ces amas de protéines amyloïdes, qui se fixent spécifiquement aux synapses, perturbent leur fonction, leur morphologie et leur maintien au cours du temps.
A?o : des ligands pathologiques
Ces scientifiques ont utilisé le suivi de particules isolées d’oligomères A?o marqués avec des nanoparticules sur des neurones d’hippocampe de souris. Cette zone du cerveau est responsable de la mémorisation. Grâce à ce marquage de nanoparticules mis au point dans le laboratoire d’Antoine Triller, les chercheurs ont pu observer des phénomènes qui se passent à l’échelle du micromètre avec une résolution de l’ordre du 1/100e de micromètre. Ils ont montré que les d’oligomères béta-amyloïdes fixés à la membrane se déplacent librement à la surface des neurones. Par la suite, leur diffusion latérale est nettement freinée en raison de leur accumulation au niveau des synapses excitatrices : des agrégats amyloïdes se forment et grossissent avec le temps.
Des amas de récepteurs au glutamate : une toxicité synaptique
Simultanément à leur formation, ces agrégats pathologiques entrainent une diminution de la mobilité de certains récepteurs du glutamate (1), les mGluR5, auxquels ils se lient. De façon surprenante, les scientifiques ont constaté que ces derniers s’agglutinent les uns aux autres et forment des domaines responsables d’une élévation du calcium intracellulaire lui-même à l’origine d’une toxicité synaptique. Ce phénomène provoque la détérioration des synapses. Ces résultats révèlent un nouveau mécanisme physiopathologique par lequel les oligomères bêta-amyloïdes induisent l’accumulation anormale et la stabilisation excessive d’un récepteur du glutamate. Cet effet toxique peut être prévenu par des antagonistes du récepteur mGluR5.
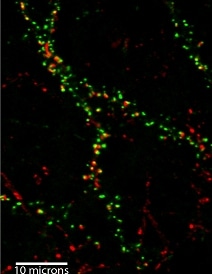
Les oligomères de béta amyloïde (rouge) se sont accumulés à proximité des synapses (vert). © Inserm
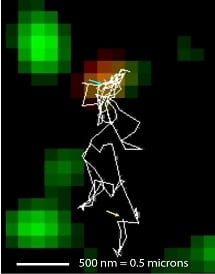
Trajectoire (blanc) d'un oligomère de béta amyloïde (rouge) rejoignant une synapse (verte) © Inserm
Notes :
(1) Le glutamate est le neurotransmetteur excitateur le plus répandu dans le système nerveux central.
Références :
Deleterious effects of amyloid ? oligomers acting as an extracellular scaffold for mGluR5
Marianne Renner1,2, Pascale N. Lacor3, Pauline T. Velasco3, Jian Xu4, Anis Contractor4, William L. Klein3 and Antoine Triller1,2
1 Inserm, Biologie Cellulaire de la Synapse, 46 rue d’Ulm, 75005 Paris, France
2 Ecole Normale Supérieure, 46 rue d’Ulm, 75005 Paris, France
3 Neurobiology and Physiology Department, Northwestern University, Evanston IL 60208 USA
4 Department of Physiology, Northwestern University School of Medicine, Chicago, IL 60611, USA
Neuron, 10 juin 2010
Source: communiqué de presse du CNRS
Laisser un commentaire