Maryse Lebrun, directrice de recherche à l’Inserm et ses collaborateurs du laboratoire Dynamique des interactions membranaires normales et pathologiques (CNRS/Universités Montpellier 1 et 2), ont caractérisé un complexe de protéines qui permet aux agents responsables du paludisme et de la toxoplasmose d’infecter les cellules hôtes. Un mécanisme très original car le parasite fournit à la fois le récepteur qu’il insère dans la membrane de la cellule hôte et le ligand qu’il expose à sa surface. La structure tridimensionnelle du complexe vient d’être élucidée par les chercheurs. Ces nouvelles données sont publiées dans la revue Science datée du 22 juillet 2011. En vue : la conception de molécules capables d’inhiber la formation du complexe protéique en question et de bloquer l’invasion de Plasmodium falciparum dans les globules rouges.
Les Apicomplexes constituent une vaste famille de parasites responsables de nombreuses maladies chez l’homme et chez les animaux: c’est le cas de Plasmodium, parasite responsable du paludisme et de Toxoplasma gondii agent de la toxoplasmose. Le paludisme entraîne la mort de plus d’un million d’individus chaque année. Plus du tiers de la population mondiale y est exposé et le parasite a développé des mécanismes de résistance à la plupart des médicaments disponibles. La toxoplasmose, quant à elle, est placée au premier rang des infections congénitales.
Ces parasites intracellulaires pénètrent à l’intérieur des cellules des organismes qu’ils infectent. Le laboratoire de recherche montpelliérain étudie les mécanismes liés à l’invasion de la cellule-hôte, étape cruciale au développement de l’infection, dont ils recherchent les spécificités afin de développer de nouvelles cibles thérapeutiques.
Les chercheurs de l’Inserm et du CNRS ont récemment décrypté au niveau cellulaire et moléculaire le mécanisme d’entrée des Apicomplexes dans la cellule. Il repose sur la formation d’un complexe protéique à l’interface de la membrane de la cellule hôte et de celle du parasite, constituant une structure appelée jonction mobile (JM). Ce mécanisme est très original car le parasite fournit à la fois le récepteur (RON2) qu’il insère dans la membrane de la cellule hôte et le ligand (AMA1) qu’il expose à sa surface. Ces protéines sont absentes chez l’hôte et ce mécanisme est donc spécifique aux Apicomplexes. Les chercheurs ont délimité dans RON2 une courte région peptidique capable de lier AMA1 avec une très forte affinité et qui inhibe l’invasion du parasite.
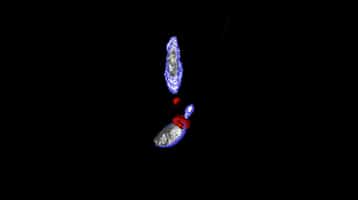
Reconstitution tridimensionnelle du complexe RON à la jonction de Toxoplasma gondii et sa cellule hôte lors de l'invasion du parasite dans la cellule hôte. L'anneau en rouge correspond à la protéine RON2 et délimite la partie intra- et extra-cellulaire du parasite. Images obtenues par les chercheurs de l'UMR5235 CNRS Université Montpellier 2 - © Images obtenues par les chercheurs de l'UMR5235 CNRS Université Montpellier 2
En collaboration avec un groupe Canadien (University of Victoria, à Vancouver) les chercheurs ont cristallisé le complexe AMA1-peptide RON2 chez Toxoplasma et cartographié les acides aminés essentiels à l’interaction AMA1-RON2 et la formation de la JM in vivo. Le peptide RON2 s’insère dans un sillon hydrophobe d’AMA1 et permettrait au parasite de vaincre les contraintes mécaniques rencontrées lors de l’invasion de la cellule hôte. « L’analyse de la relation « structure/fonction » et la modélisation du complexe équivalent de Plasmodium falciparum nous ont permis de délimiter sur RON2 une zone plus particulièrement impliquée dans la spécificité de l’interaction parmi les différents Apicomplexes et de comprendre les mécanismes d’inhibition d’invasion des anticorps dirigés contre AMA1» précise Maryse Lebrun. L’ensemble de ces données offre des bases à la conception de molécules capables d’inhiber la formation du complexe AMA1-RON2 et l’invasion de P. falciparum dans les globules rouges.
De plus, le complexe AMA1-RON2 étant conservé chez des Apicomplexes responsables d’infections vétérinaires à fort impact économique comme les coccidioses aviaires, la piroplasmose, la néosporose, la toxoplasmose ovine, cette stratégie est également généralisable à la lutte contre d’autres infections parasitaires. Les résultats de ce projet sont donc potentiellement à l’origine d’applications directes sur le plan médical et vétérinaire.
Références :
Host cell invasion by Apicomplexan parasites: Insights from the structure of AMA1 in complex with a RON2 peptide – M.L. Tonkin, M.Roques, M.H. Lamarque, M.Pugnière, D.Douguet,Joanna Crawford, M.Lebrun, M.J. Boulanger – Science, juillet 2011
Consulter le site web
Source : communiqué de presse du CNRS
Laisser un commentaire