Un des aspects les plus étonnants du développement embryonnaire des mammifères est que, chez la femelle, il s’accompagne de l’inactivation précoce de l’un des deux chromosomes X, le maternel ou le paternel.
En observant ce phénomène in vivo, dans des cellules de souris, l’équipe d’Edith Heard (Institut Curie/CNRS UMR 3215/Inserm U934) révèle comment s’opère le choix du chromosome X à éteindre. Cette même équipe montre par ailleurs la surprenante diversité des stratégies pour arriver à l’extinction d’un des deux chromosomes X chez les mammifères au cours du développement et au cours de l’évolution. Cell et Nature présentent ces travaux innovants en ligne.
Le système de détermination sexuelle de la majorité des mammifères repose sur les deux chromosomes sexuels : les mâles possèdent un chromosome X et un Y, alors que les femelles ont deux chromosomes X. Le chromosome Y, plus petit que le chromosome X, contient beaucoup moins de gènes. Mais, la nature dans sa grande générosité rétablit la parité génétique puisque, chez les femelles, un des chromosomes X (celui hérité de la mère ou du père) est inactivé très tôt au cours du développement de l’embryon et les quelque 2 000 gènes portés par celui-ci sont « éteints ».
«Chez la souris, l’extinction du chromosome X lors du développement embryonnaire suit une dynamique complexe. Le chromosome X paternel est dans un premier temps systématiquement inactivé puis réactivé. C’est seulement dans un deuxième temps, que se produit l’inactivation aléatoire d’un des deux X qui aboutit à une mosaïque de populations cellulaires dont certaines expriment l’X maternel et d’autres l’X paternel»explique Edith Heard, chef de l’équipe « Epigenèse et développement des mammifères » (Institut Curie/CNRS UMR 3215/Inserm U934).
Une fois établie dans les cellules somatiques(1), l’inactivation est stable et se transmet au cours des divisions cellulaires. Dans l’ensemble des cellules des mammifères femelles, l’un des deux chromosomes X est inactif alors que son homologue, présent dans le même noyau, reste actif.
La réactivation complète ou partielle du chromosome X est parfois observée lors d’un processus normal dans les cellules germinales ou suite à une erreur dans les cellules cancéreuses.
Comment ce chromosome est-il éteint au cours du développement ? On sait déjà que cette inactivation ne dépend pas d’un changement dans la nature des gènes, mais d’une modification dans la façon dont ils sont exprimés. En revanche, savoir comment s’opère le choix entre ces deux chromosomes reste une question ouverte.
Concrètement, une région précise du chromosome X, le centre d’inactivation, produit un transcrit non-codant(2), Xist, qui rend « silencieux » les gènes qu’il recouvre. Mais les choses ne sont pas « si simple » puisqu’un autre ARN non codant, Tsix, a la capacité de bloquer la production de Xist. Une sorte de « rivalité » s’organise donc entre Xist et Tsix qui aboutit à l’extinction de l’un des deux chromosomes X.
L’équipe d’Edith Heard vient pour la première fois de visualiser en temps réel la chorégraphie spatio-temporelle des chromosomes X pendant la différenciation précoce de cellules souches embryonnaires chez la souris. «Tout n’est pas dicté par les gènes ; les interactions entre les chromosomes, et notamment les contacts entre des régions bien précises de ceux-ci, sont de plus en plus souvent associées à la régulation des gènes et de leur expression. D’où l’intérêt de suivre in vivo les mécanismes se déroulant dans les cellules», explique Edith Heard.
C’est un véritable tango entre les deux X auquel assistent les chercheurs lors de la différenciation cellulaire. Accélération, langueur, rapprochement, éloignement… tels sont la chorégraphie et les rythmes in vivo des loci(3) (Tsix, Xist…) pendant l’extinction du chromosome X. Au début de la différenciation, le tango s’emballe : les loci multiplient les interactions courtes entre eux. Ensuite, les Tsix, pris de langueur, restent environ 45 minutes tellement proches qu’ils sont presque « accrochés » l’un à l’autre.
Que se passe-t-il entre eux ? Les chercheurs montrent qu’à la suite de ce rapprochement, le locus Tsix est éteint transitoirement sur un des deux chromosomes X, ce qui entraîne probablement la surexpression et l’accumulation ultérieures de Xist sur ce chromosome. Ce contact prolongé semble déclencher une asymétrie dans l’expression de Xist et ainsi amorcer le choix du chromosome X à éteindre.
Ces travaux ont permis de réaliser, chez la souris, l’une des premières visualisations in vivo de la dynamique des régions chromosomiques impliqués dans l’extinction du chromosome X.«Nous démontrons ainsi que des interactions transitoires entre deux chromosomes peuvent participer à la régulation précise de l’expression des gènes dans les cellules» ajoute Edith Heard.
A chacun sa danse pour réguler l’expression de X
Même si l’inactivation du chromosome X chez la femelle semble être un phénomène conservé chez les mammifères, la manière dont elle s’établit chez la souris ne reflète pas forcément ce qui se passe pour d’autres espèces. L’équipe d’Edith Heard, en collaboration avec celle de Véronique Duranthon (UMR 1198 INRA-ENVA), s’est intéressée au degré de conservation de l’inactivation du chromosome X entre différents mammifères. Ils montrent que dans les embryons humains ou de lapin, la mise en place de cette inactivation suit des cinétiques précoces très différentes de celles de la souris. La régulation de Xist semble très différente entre les espèces, même si la finalité – c’est à dire l’inactivation d’un des deux chromosomes X – reste la même. Alors qu’au cours de l’embryogenèse précoce chez la souris, le chromosome X paternel est systématiquement inactivé puis réactivé, ce type de régulation n’est pas retrouvé chez l’humain ou le lapin. De la même façon, même si Tsix joue un rôle important dans l’inactivation aléatoire du X chez la souris, il ne semble pas avoir d’équivalent chez l’homme et le lapin.
«Certaines des observations préalablement faites chez la souris ne peuvent pas forcement être étendues aux autres espèces. Néanmoins, la compréhension du processus d’inactivation du chromosome X chez les mammifères s’est beaucoup basée sur les études faites chez la souris, qui reste un beau modèle pour la compréhension des mécanismes épigénétiques» explique Edith Heard.
Au cours de l’évolution, les mammifères ont donc adopté des stratégies légèrement différentes pour établir «l’égalité génétique» entre les sexes.
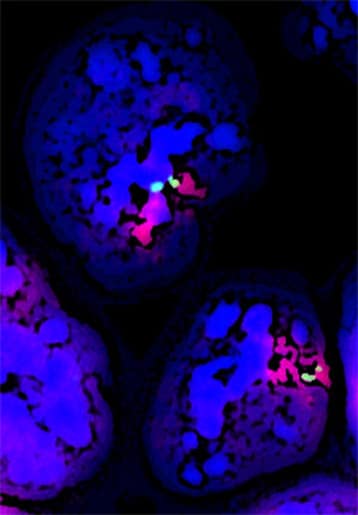
Le marquage bleu correspond au noyau, le vert aux chromosomes X et le rouge au gène Xist - © E. Heard/Institut Curie
Notes :
(1) Les cellules somatiques sont toutes les cellules animales qui ne seront jamais à l’origine des spermatozoïdes et ovules, contrairement aux cellules germinales. Les cellules somatiques représentent l’immense majorité des cellules constituant un individu.
(2) Transcrit non-codant : il s’agit d’un ARN, issu de la transcription de l’ADN, qui ne sera pas traduit en protéine.
(3) Un locus est un emplacement physique précis et invariable sur un chromosome.
Références :
Live cell chromosome dynamics and outcome of X-chromosome pairing events during ES cell differentiation
O.Masui, I.Bonnet, P.Le Baccon, I.Brito, T.Pollex, N. Murphy, P.Hupé, E.Barillot, A.Belmont, E.Heard.
Cell, 29 avril 2011, publication en ligne
Eutherian mammals use different strategies to initiate X inactivation during development.
I. Okamoto, C.Patrat, D.Thépot, N.Peynot, P.Fauque, N.Daniel, P.Diabangouaya, JP.Wolf, JP.Renard, V.Duranthon, E.Heard.
Nature, 21 avril 2011, 472(7343):370-4.
Source : communiqué de presse du CNRS
Laisser un commentaire