L’obésité, outre ses conséquences directes sur la santé (maladies cardiovasculaires, diabète), est de plus en plus soupçonnée de jouer un rôle dans le pronostic du cancer du sein en particulier dans sa propension à se répandre. Pour autant, aucune relation de cause à effet n’avait, jusqu’à présent, été démontrée. C’est chose faite grâce aux travaux menés par deux équipes de recherche réunissant des chercheurs de l’Inserm, du CNRS et de l’Université Paul Sabatier. Les travaux conjoints des scientifiques ont permis de mettre en évidence in vitro et in vivo, à proximité des cancers du sein, des cellules du tissu graisseux, appelées adipocytes, aux caractéristiques biologiques spécifiques. Ces adipocytes associés aux tumeurs sont capables de modifier les caractéristiques de la cellule cancéreuse, la rendant plus agressive. Les résultats de ces travaux sont publiés le 1er avril 2011 dans Cancer Research.
Chez les femmes, de nombreuses études statistiques ont déjà établi un lien, sans pour autant jamais parvenir à en expliquer la raison, entre obésité et « agressivité » du cancer du sein. Afin de trouver une explication à ce phénomène, les chercheurs ont étudié la nature du dialogue entre ces cellules graisseuses et les cellules de la tumeur.
La partie externe du sein est essentiellement constituée de tissu graisseux, lui-même majoritairement composé d’adipocytes. Ces cellules sont capables, outre leur activité de stockage/libération des graisses, de sécréter de nombreuses protéines. Les chercheurs ont donc cherché à savoir si ces protéines jouaient un rôle dans le développement des cancers du sein.
Pour cela, les équipes de Philippe Valet à l’Institut des maladies métaboliques et cardiovasculaires (Inserm/Université Paul Sabatier) et de Catherine Muller à l’Institut de pharmacologie et de biologie structurale (CNRS/Université Paul Sabatier) ont utilisé un système de co-culture original entre cellules tumorales mammaires et adipocytes. En présence des cellules tumorales, les adipocytes manifestent une modification de la sécrétion de certaines de leurs protéines, dont des protéines de l’inflammation comme l’interleukine 6. Peu à peu, ils établissent une véritable interaction avec la tumeur, qui conduit à l’augmentation de son « potentiel de colonisation », donc de son agressivité.
En effet, lorsque des injections de cellules tumorales préalablement co-cultivées avec des adipocytes sont réalisées chez des souris, les chercheurs relèvent un accroissement des capacités de la tumeur à former des métastases. Fait majeur, ces modifications spécifiques des adipocytes ont été retrouvées dans des tumeurs humaines, confirmant l’importance de ce phénomène. De plus, les chercheurs observent qu’à proximité des tumeurs humaines de grande taille, avec envahissement ganglionnaire, une plus grande quantité d’interleukine 6 (IL-6) est retrouvée dans les adipocytes. Cette protéine jouerait donc un rôle important dans la propagation du cancer du sein stimulée par les adipocytes.
Ce travail montre que les adipocytes sont sans doute des acteurs inattendus de la dissémination de ces tumeurs. « Nos résultats démontrent aujourd’hui comment les adipocytes participent activement à la progression du cancer orchestrée par les cellules tumorales. Ils suggèrent qu’en cas d’obésité, les adipocytes associés au cancer du sein seraient plus enclins à amplifier l’effet “agressif” des tumeurs », précisent les chercheurs. « Cette hypothèse reste à vérifier à la fois chez la souris et chez l’homme» estiment-ils.
En vue : la mise au point de stratégies spécifiques destinées aux patients en surpoids atteints de cancers les plus agressifs. Par exemple, identifier les signaux fournis par les adipocytes pour stimuler les propriétés d’invasion des cellules tumorales pourrait représenter une nouvelle piste pour traiter ces patients.
Ces travaux ont bénéficié du soutien financier de l’Institut National du Cancer.
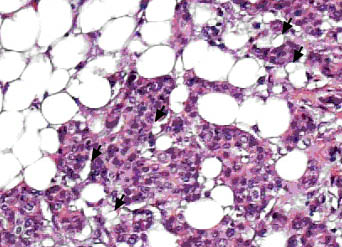
Coupe de tumeur (mauve) en présence d'adipocytes (disques blancs. Les fleches indiquent des adipocytes modifiés par la tumeur - © G. Escourrou
Références :
Cancer-associated adipocytes exhibit an activated phenotype and contribute to breast cancer invasion”, Béatrice Dirat1,2,3, Ludivine Bochet 1,2,3, Marta Dabek1,2, Danièle Daviaud1,3, Stéphanie Dauvillier1,2, Bilal Majed4, Yuan Yuan Wang1,2,3, Aline Meulle1,2,3, Bernard Salles1,2, Sophie Le Gonidec1,3, Ignacio Garrido5, Ghislaine Escourrou6, Philippe Valet1,3 and Catherine Muller1,2
1 Université de Toulouse, UPS, F-31077 Toulouse, France
2 CNRS ; Institut de Pharmacologie et de Biologie Structurale F-31077 Toulouse, France
3 Institut National de la Santé et de la Recherche médicale, INSERM U1048, F-31432 Toulouse, France
4 Département de Biosatistiques, Institut Curie, 75005, Paris, France et Unité d’Epidémiologie et de Recherche
Clinique, Hôpital d’Arras, 62000 Arras, France.
5 Département de Chirurgie Oncologique, Institut Claudius Regaud, 31052 Toulouse, France
6 Service d’Anatomo-Pathologie, Hôpital de Rangueil, 31403 Toulouse, France.
Cancer Research, 1er avril 2011.
Source: communiqué de presse du CNRS
Laisser un commentaire