Deux équipes de l’Institut Pasteur associées au CNRS publient dans la revue Nature la structure tridimensionnelle de deux anesthésiques généraux associés à leur récepteur membranaire. Ces recherches fournissent les premières structures à résolution atomique pour comprendre le mode d’action des anesthésiques, qui depuis leur découverte il y a deux siècles est resté mal connu. Elles pourraient ainsi constituer une première étape vers la conception de nouveaux composés, plus spécifiques et présentant moins d’effets secondaires.
Les chercheurs du groupe Récepteurs-canaux (Institut Pasteur/CNRS URA 2182) et de l’unité de Dynamique structurale des macromolécules (Institut Pasteur/CNRS, URA 2185) dirigés respectivement par Pierre-Jean Corringer et Marc Delarue, viennent de déterminer la structure tridimensionnelle de deux anesthésiques généraux, le propofol et le desflurane, en complexe avec un récepteur-canal de la membrane cellulaire.
Les chercheurs ont cristallisé puis analysé par diffraction aux rayons X le complexe, jusqu’alors jamais observé, formé par ce canal et les anesthésiques. Ils ont pour cela utilisé un homologue bactérien du canal GABAA, qu’ils ont découvert en 2007 (1). Le récepteur GABAA est en effet l’une des principales cibles membranaires pour les molécules anesthésiques. Chez l’homme, il assure la grande majorité de la transmission du message nerveux inhibiteur.
Grâce à la résolution à l’échelle atomique de la structure du complexe, les scientifiques de l’Institut Pasteur et du CNRS ont pu identifier des sites de liaison auxquels les anesthésiques se lient spécifiquement. Ils ont également montré qu’il est possible de moduler l’affinité de l’anesthésique pour son récepteur et l’activité de ce dernier en modifiant légèrement la configuration des sites de liaison. Ces résultats corroborent les données de la littérature scientifique selon lesquelles la fixation de la molécule anesthésique potentialise l’effet inhibiteur du récepteur, bloquant ainsi davantage la transmission des messages nerveux, comme la sensation douloureuse, par exemple.
Cette étude apporte pour la première fois des éléments structuraux à haute résolution sous-tendant l’action des anesthésiques généraux. En effet, si leur découverte il y a deux siècles, avec l’utilisation de l’éther, a révolutionné la chirurgie, les mécanismes expliquant leur action restent mal connus.
Le franchissement de cette étape clé ouvre donc la voie à la conception et à la mise au point, grâce aux technologies de la modélisation moléculaire, de nouvelles molécules, plus spécifiques et aux effets secondaires réduits.
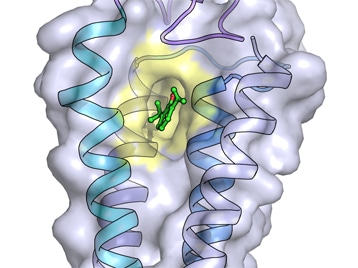
Modélisation 3D du propofol en complexe avec l'homologue du récepteur GABAA. © H. Nury/Institut Pasteur
Notes :
(1) Lire le communiqué du 5 novembre 2008 : Consulter le site web
Références :
X-Ray structures of general anaesthetics bound to a pentameric ligand-gated ion channel, Nature,
Hugues Nury (1-4), Catherine Van Renterghem (1,2), Yun Weng (5), Alphonso Tran (5), Marc Baaden (6), Virginie Dufresne (1,2), Jean-Pierre Changeux (7,2-, James M. Sonner (5), Marc Delarue (3,4), Pierre-Jean Corringer (1,2)
Source: communiqué de presse du CNRS
Laisser un commentaire