Des chercheurs du CEA(1), de l’Université Joseph Fourier et du CNRS viennent de mettre au point une nouvelle approche combinant cristallographie des protéines et chimie biomimétique pour observer toutes les étapes clés d’un processus essentiel à la vie, l’activation de l’oxygène. Pour cela, ils ont créé une métalloenzyme artificielle, complexe constitué d’un catalyseur chimique et d’une protéine et l’ont observée par cristallographie aux rayons X sur une ligne de lumière de l’installation européenne de rayonnement synchrotron (ESRF). Ces résultats constituent une étape essentielle pour le développement de métalloenzymes artificielles capables de produire, efficacement et à moindre coût, de nombreuses molécules d’intérêt industriel. Ce faisant, ils ouvrent de nouvelles perspectives pour la chimie verte. Ces travaux sont publiés en ligne par la revue Nature Chemistry.
De nombreuses molécules chimiques existent sous deux formes aux structures inversées comme dans un miroir (énantiomères). Souvent, seule l’une de ces formes présente un intérêt pour les industries de la santé, de l’agriculture ou de l’alimentation. Or, la synthèse chimique des molécules présente le désavantage d’aboutir à la production des deux formes de la molécule (catalyse énantiosélective), et donc d’une quantité non négligeable de molécule sans intérêt. Isoler la forme recherchée nécessite de procéder à des phases lourdes et coûteuses de purification.
La nature est beaucoup plus performante que la chimie de synthèse : les enzymes sont en général capables de fabriquer directement la forme d’intérêt d’une molécule ! D’où l’idée de les utiliser dans l’industrie. Cependant, le nombre d’enzymes naturelles disponibles pour effectuer les réactions d’intérêt reste faible. Par ailleurs, la catalyse chimique homogène(2) permet de réaliser de nombreuses réactions, mais souvent avec une faible stabilité des catalyseurs et un manque de spécificité.
C’est de ce double constat qu’est née l’idée de combiner chimie et biologie pour créer des métalloenzymes artificielles. Leur structure est constituée d’un catalyseur inorganique inséré dans une structure protéique inactive. Chacun son rôle : le catalyseur inorganique dicte la nature de la réaction jouant le rôle du site actif(3) de l’enzyme et l’échafaudage protéique contrôle la production de la forme d’intérêt du produit et l’efficacité de la réaction.
Si ces métalloenzymes artificielles offrent conceptuellement des perspectives énormes pour la chimie verte, il faut encore relever un défi technologique pour développer par ingénierie des enzymes efficaces pour la production de chaque molécule d’intérêt. Pour cela, il faut trouver le meilleur couple protéine/catalyseur, comprendre son fonctionnement, et l’adapter…
Avec ces travaux, les chercheurs viennent de réaliser une étape essentielle du développement de ces métalloenzymes. Ils ont en effet mis au point une méthode qui permet de suivre la réaction chimique au niveau du site actif au cours du temps. « Dans le cas présent nous avons regardé le fonctionnement d’une réaction qui consiste à activer l’oxygène moléculaire. Cette réaction est utilisée dans de nombreux processus cellulaires essentiels à la vie », explique Stéphane Ménage, chercheur CNRS au sein de l’équipe Chimie rédox bioinspirée de l’iRTSV (Institut de recherches en technologies et sciences pour le vivant).
Pour étudier cette réaction, les chercheurs ont élaboré un mime de la réaction via l’introduction d’un cycle aromatique au sein d’un complexe de fer, puis inséré ce complexe dans une protéine(4) qui a pour unique fonction le transport du Nickel chez la bactérie Escherichia coli(5). Elle ne perturbe donc pas la réaction chimique d’activation de l’oxygène. Les chercheurs ont ensuite cristallisé cette métalloenzyme artificielle et observé en direct par cristallographie aux rayons X l’évolution de la réaction au sein du cristal. « Ce dernier permet la diffusion des substrats et des intermédiaires de la réaction. L’enzyme reste active dans le cristal, la réaction peut se faire et il est possible d’en suivre les différentes étapes in cristallo », précise Christine Cavazza, chercheuse CEA au Laboratoire de cristallographie et de cristallogenèse des protéines de l’IBS (Institut de biologie structurale). « Nous pouvons ainsi observer l’insertion d’atomes d’oxygène au sein du noyau aromatique ».
« Le plus extraordinaire pour nous autres chimistes, c’est qu’avec cette construction qui allie propriétés chimiques et biologiques nous avons pu voir toutes les étapes de cette réaction, ce qu’aucun chimiste n’avait réussi à faire ! », s’enthousiasme Stéphane Ménage. « C’est une étape essentielle pour étudier comment fonctionne le site actif synthétisé chimiquement. On peut ensuite le moduler pour adapter sa structure aux performances recherchées ».
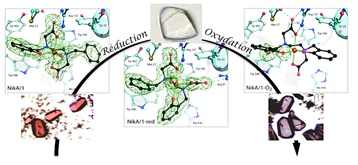
Exemple de cinétique chimique in cristallo : à gauche - Complexe de Fer dans un cristal de protéine ; au centre - Changement de conformation du complexe après réduction du Fer ; à droite - Insertion d'un oxygène dans le complexe après activation de l'oxygène moléculaire. © CEA
Notes :
(1) Laboratoire de cristallographie et de cristallogenèse des protéines, Institut de biologie structurale J.P. Ebel (CEA/CNRS/Université Joseph Fourier) – Laboratoire de chimie et biologie des métaux (Université Joseph Fourier/CEA/CNRS), Institut de recherches en technologies et sciences pour le vivant (iRSTV).
(2) Catalyse homogène : un catalyseur est dit homogène lorsqu’il ne forme qu’une seule phase avec le solvant et les réactifs. Jouant son rôle de catalyse, il est consommé lors de la première étape de la réaction, puis il est restitué sous sa forme initiale. Il n’apparaît donc pas dans la réaction globale.
(3) Le site actif d’une protéine est la partie de cette protéine ou se produit la réaction enzymatique.
(4) La protéine en question est la protéine Nika.
(5) Escherichia Coli est une bactérie intestinale des mammifères très commune chez l’être humain.
Références :
Crystallographic snapshots of the reaction of aromatic C–H with O2 catalysed by a protein-bound iron complex. Christine Cavazza, Constance Bochot, Pierre Rousselot-Pailley, Philippe Carpentier, Mickaël V. Cherrier, Lydie Martin, Caroline Marchi-Delapierre, Juan C. Fontecilla-Camps and Stéphane Ménage. Nature Chemistry, online, 2010
Source: communiqué de presse du CNRS
Laisser un commentaire